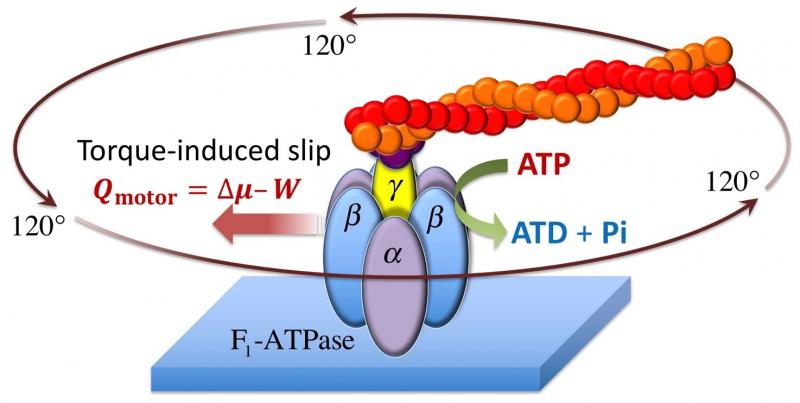
F1-ATPaseは生命のエネルギー通貨と呼ばれているATP(アデノシン3リン酸)の加水分解エネルギーを仕事へ変換する、タンパク質でできた回転分子モーター(図1)として知られており、一方細胞内では、生体膜内外のプロトン濃度差を利用して逆にATPを生成する、FOF1-ATP合成酵素の一部として働いています。ヒトの場合、1日で30kgものATP合成を担う、極めて重要なタンパク質です。
岡山大学異分野基礎科学研究所の墨智成准教授およびGöttingen 大学Stefan Klumpp教授は、F1分子モーターの1分子計測データを理論的に分析し、そのエネルギー変換効率は、分子内熱散逸のため、100%を優位に下回る(40~80%程度である)ことを定量的に実証しました。本研究成果は4月24日、アメリカ化学会誌「Nano Letters」に掲載されました。
F1はゆらぐミクロ系の熱力学を適用するモデルシステムとしても重要な役割を演じており、電動モーター(逆回転で発電する)と同様な高い可逆性を有する「ナノ分子機械」としても注目を集めています。そのエネルギー変換効率は長年に渡り議論されており、ほぼ100%に達していると考えられていました。本研究では、その根拠の一つとなっている1分子計測データを定量的に分析し、F1による回転力と外部トルクが釣り合った停止状態においても、スリップ逆回転に起因した内部熱散逸が生じるため、変換効率は条件に応じて40~80%程度であることを示しました。
本研究成果は、分子の柔らかさに起因したナノ分子機械内部で起きうる熱散逸の一例を示しており、より高性能な人工ナノ分子機械の設計指針へとつながる知見であるといえます。
- 論文情報
- 論文名:Is F1-ATPase a rotary motor with nearly 100% efficiency? Quantitative analysis of chemomechanical coupling and mechanical slip
- 掲載誌:Nano Letters
- 著者:Tomonari Sumi, Stefan Klumpp
- DOI:https://doi.org/10.1021/acs.nanolett.9b01181
- 岡大プレスリリース
- 理論物理科学研究室
なお,本研究は,2019年6月21日の科学新聞で紹介されました。

- 科学新聞2019年6月21日掲載
- 科学新聞社の許可を得て掲載しております。転載はご遠慮ください。






